5月29日,第二批临床急需境外新药名单正式稿公布,剔除了征求意见稿的5个产品,并新增了1个产品,最终26个产品入围。加上第一批正式稿名单的40个产品,合计两批66个产品入围。
据相关规定,纳入境外已上市临床急需新药名单的药品,尚未进行申报的或正在我国开展临床试验的,经申请人研究认为不存在人种差异的,均可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请,国家药品监督管理局将按照优先审评审批程序,加快审评审批。
进入临床急需境外新药名单无疑是一条新药加速上市的快道。那么,临床急需境外新药名单中的上市产品,是否豁免了临床呢?从临床到上市预计要耗费多久呢?本文一一揭示。
两批名单汇总
筛出16个已上市产品
2018年8月,第一批临床急需境外新药名单征求意见稿发布,共48个产品进入目录。2018年11月,第一批临床急需境外新药名单正式稿公布,与征求意见稿相比,剔除了8个产品,这些产品都是在正式稿发布前就获批上市。
2019年3月,第二批临床急需境外新药名单征求意见稿发布,共30个产品进入目录。2019年5月,第二批临床急需境外新药名单正式稿公布,剔除了征求意见稿的5个产品,并新增了1个产品。新增的产品是NORDITROPIN(somatropin)injection,该产品主要治疗内分泌和代谢疾病努南(Noonan)综合征和普拉德-威利(Prader-Willi)综合征,同样适应症的利维米尔-地特胰岛素注射液被剔除了。
2个流感药物都被剔除,包括治疗和预防A型和B型流感病毒感染的拉尼米韦辛酸酯水合物干粉吸入剂,以及治疗甲型和乙型流感的博洛昔韦片。治疗高胆固醇血症的阿莫罗布单抗和治疗4岁以上儿童及青少年严重性春季角膜结膜炎(VKC)的环孢素滴眼液也被剔除。但治疗角膜炎的重组人神经生长因子滴眼液则被保留。
第一批征求意见稿和正式稿目录中共有15个产品已上市。其中,被正式稿剔除的有8个产品(阿来替尼、依库珠单抗、恩曲他滨/替诺福韦酯艾拉酚胺/艾维雷韦/可比司他、依洛尤单抗、奥拉帕利、哌柏西利、帕博丽珠单抗和特立氟胺)。正式稿发布后又上市了7个产品,其中2018年上市的2个产品为来迪派韦索磷布韦片和司来帕格,2019年上市的5个产品为地舒单抗、依洛硫酸酯酶α、诺西那生钠、重组带状疱疹疫苗和司库奇尤单抗注射液。
第二批目录在正式稿公布以前已上市的产品有贝前列素钠片、阿达木单抗、格卡瑞韦哌仑他韦片和西地那非片4个,其中贝前列素钠片、阿达木单抗和西地那非片3个产品是增加适应症。
因此,如果把两批征求意见稿和两批正式稿产品都纳入,那么临床急需境外新药名单共涉及79个产品中,已在国内上市的产品有19个。剔除增加适应症的3个产品,最终筛选出16个已上市产品。由于上市产品样本量太小,因此把两批征求意见稿和正式稿的产品都纳入筛选与分析。
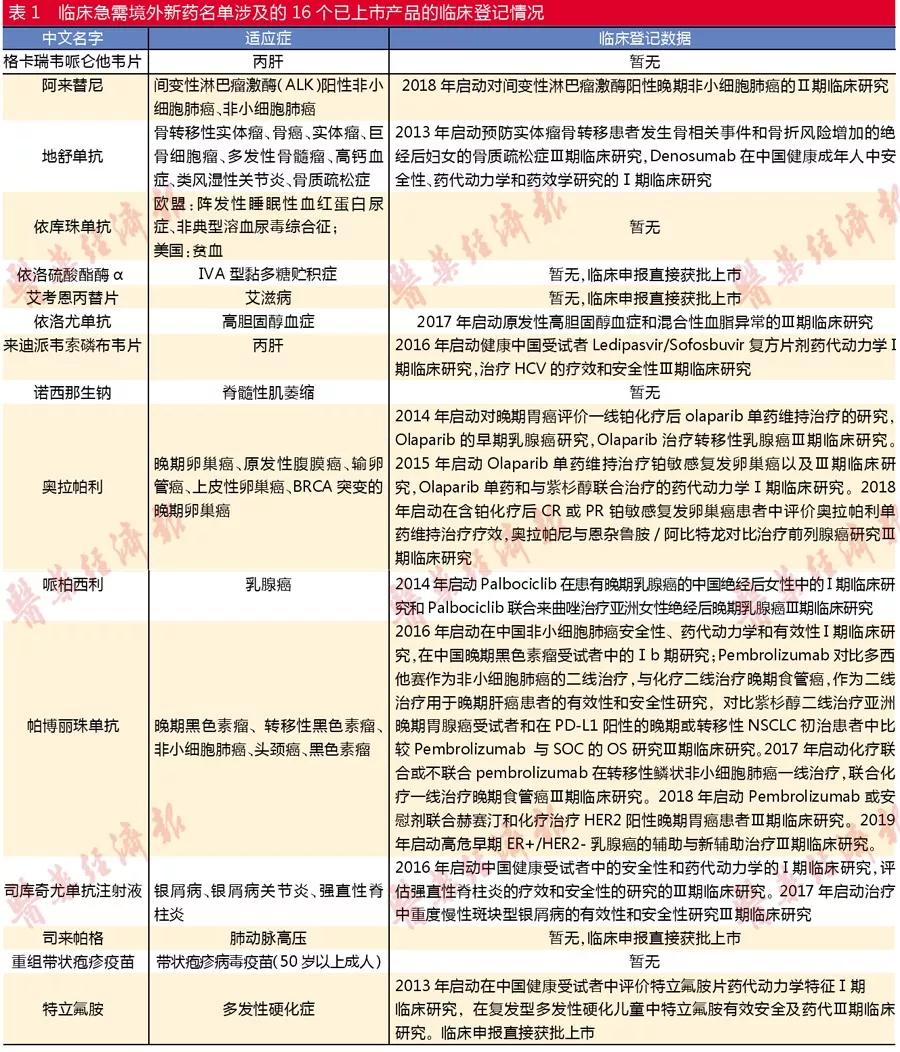
上市速度PK
豁免临床直接申报>临床阶段直接获批
相较于欧美日首次批准日期,临床急需境外新药名单已上市的产品要平均晚52个月上市,亦即普遍比欧美日上市晚4年。其中,依库珠单抗欧美日首次上市年为2007年,地舒单抗欧美日首次上市年为2010年,我国上市分别晚了135个月和108个月。重组带状疱疹疫苗是欧美日上市后最快上市的产品,仅晚了20个月。
未进入正式名单的8个第一批已上市产品从临床到上市平均时间是56个月。其中,特立氟胺和艾考恩丙替片属于临床申报直接获批上市的,分别再经过52个月和30个月后上市。不过,其余6个产品从上市申报到获批平均仅用10个月。
进入正式名单的近两年上市的8个产品中,诺西那生钠、格卡瑞韦哌仑他韦片、重组带状疱疹疫苗这3个产品没有申报临床就直接申报上市并获批,从申报到上市平均耗了8个月。其余5个产品都有临床申报记录,从临床申报到上市,平均耗费37个月。依洛硫酸酯酶α和司来帕格在临床申报后直接获批,但仍需要28个月和21个月;其他3个产品需要平均45个月才能获批,其中耗费在上市注册到获批平均要9个月。
此外,2019年获批上市的产品从临床申报到上市平均需要40个月,上市审批时间平均8个月。相较于2018年获批的产品从临床申报到上市平均需要51个月,上市审批审批时间平均10个月,2019年获批的产品所需要等待的时间相对较短,从侧面反映了新药审评审批的速度在加快。
进入正式稿名单的产品获批后暂未有启动上市后疗效再评价的Ⅲ期临床试验。上市后还积极布局Ⅲ期临床试验的主要是阿来替尼、帕博丽珠单抗和奥拉帕利等未进入正式稿的肿瘤靶向药。
由此可见,如果产品想要加快上市,最快的是豁免临床直接申报上市,平均只需要8个月就能上市;其次是临床阶段直接获批上市,平均需要33个月才能上市。需要按临床申报和上市申报的,则平均需要55个月才能上市。
不过,临床急需境外新药名单涉及的79个产品中,能够豁免临床直接申报上市和临床阶段直接获批上市的产品占整体比例还是太小,样本量太小或许不具备代表性。
小结>>>
近日,有行业评论认为优先审评目录产品并没有加快审评,主要是因为优先审评的范围太广。实际上,除了优先审评范围太广导致太多产品进入优先审评从而优先审评产品也需要乖乖排队这个因素之外,还因为国外已上市的产品在国内上市申报还需要做一个Ⅰ期临床研究和一个Ⅲ期临床研究,这个流程完成下来普遍需要3年。
虽然不存在人种差异的,均可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请,然而资料完整的进口产品并不多,最终大多数产品还是老老实实做完Ⅰ期临床研究和Ⅲ期临床研究申报,这或许才是优先审评快不了的真正原因。



